遺伝子調節ネットワークの予測
転写制御は、大学院生だった時から私の主な研究関心であり、博士課程中には、DNA配列モチーフから遺伝子発現を予測するアプローチや、モチーフの組み合わせ、位置および向きなどプロモーターの高次プロパティを探究しました(Vandenbon and Nakai, Nucl Acids Res, 2010 を参照)。
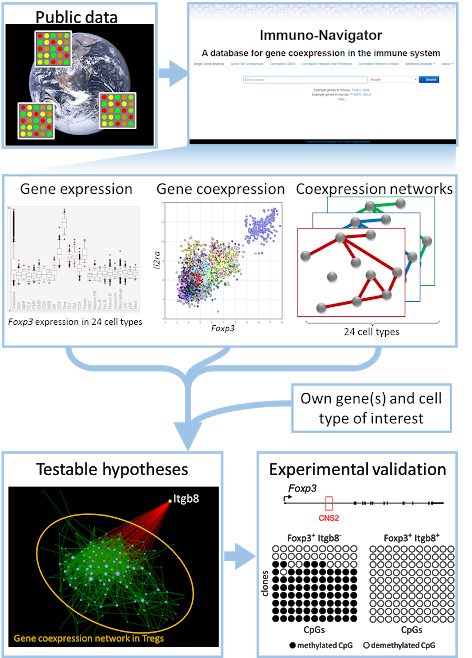
最近では、免疫系の細胞種のための遺伝子共発現データベースであるImmuno-Navigatorを構築しました(Vandenbon et al., PNAS, 2016)。この研究の重要な点は、データセットのバッチ効果を徹底的に分析して減少させ、その結果データの品質が大幅に改善されたことです。私たちは、その結果、特に Treg 細胞で重要な新しいレギュレーターを予測することに成功しました。これは、大阪大学の 坂口志文 教授の研究室との共同研究で実現しました。
免疫刺激後のエピジェネティックマーカーの変化の解析
病原体関連分子パターンを用いた免疫細胞の刺激は、遺伝子発現だけでなく、プロモーターやエンハンサー領域のエピジェネティックマーカーにも変化をもたらします。これらの変化には、ヒストンタンパク質のリシン残基のアセチル化やメチル化が含まれます。ヒストン修飾が転写の調節において有効な役割を果たすのか、それとも主に副産物であるかは、まだ明らかではありません(Henikoff and Shilatifard, Trends Genet., 2011 のレビューを参照)。我々は、リポポリサッカライド(LPS)刺激に伴い、デンドライト細胞内で転写とヒストン修飾の変化の順序を、ChIP-seqデータとバイオインフォマティクスを用いて研究しています(Vandenbon et al., Genome Biology, 2018)。我々は、転写因子と LPS 刺激によるプロモーターでのヒストン修飾の累積の間に因果関係があるかどうかを調査しています。これは、大阪大学の 熊谷雄太郎 博士(現在は 産総研)と、東京大学の 鈴木穣教授 と 中井謙太教授 との密接な共同研究です。
異分野融合型共同研究
私は、免疫学におけるいくつかの共同研究プロジェクトに参加しています。例えば、Irf4 と Jmjd3(Satoh et al、Nature Immunology、2010)、Jdp2 と Atf3 プロモーターでのヒストンアセチル化の抑制(Maruyama et al、Immunity、2012)など、転写因子とエピジェネティック調節との間の相互作用を明らかにしました。最近では、Akirin2 が NF-κB ターゲットプロモーターに SWI/SNF コンプレックスを招集する役割を解明するために貢献しました(Tartey et al、EMBO J、2014)。ゲノムワイドの Treg 特異的 DNA メチル化パターンと Foxp3 の結合を分析することにより、Treg 特異的転写調節のアプローチをより理解することができました(Morikawa et al、PNAS、2014)。遺伝子発現の転写後調節レベルでは、RIP-seq と遺伝子発現データを統合分析することで、RNase Regnase-1 のターゲット RNA を同定しました(Uehata et al、Cell、2013; Mino et al、Cell、2015)。RNA 配列および構造モチーフのバイオインフォマティクス分析により、それが認識する RNA ステムループ構造をより理解することができました。